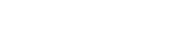간단한 화학식으로 보는 14.7 : 1
일반적으로 가솔린 기관의 이론 공연비는 14.75 : 1이라고 한다. 흔히 들을 수 있는 얘기인데도 자신있게 왜 14.75 : 1인지에 대해서 말하는 이는 드물며 또한 이것을 어떤 식으로 정비에 응용해야 하는지 알고 있는 사람 또한 드물다. 따라서 이번 호에는 화학식의 기초와 14.75 : 1을 어떤 식으로 유도하는지 알아보고 정비인의 입장에서 연료의 연소에서 발생하는 유해가스의 원인과 대책을 생각해본다.
김인옥【경기 오산 그린카프라자 대표】
화학식의 기초
원소 기호를 사용해 어떤 물질을 나타내는 것을 화학식이라고 하고, 이 화학식에는 실험식, 분자식, 시성식, 구조식 등이 있다. 화학식은 물질을 구성하는 성분 원소, 원자들의 조성비, 물질의 화학적 성질 및 원자 사이의 결합 관계를 나타낸다.
이산화탄소의 분자식은 CO2이다. CO2라는 분자식은 이산화탄소의 구성 원소는 탄소와 산소라는 사실뿐만 아니라 탄소 원자 1개와 산소 원자 2개가 결합해 이산화탄소 1분자를 이룬다는 것을 알려준다.
그러면 가장 간단한 화학식인 실험식 구하는 방법을 알아보고 실험식과 분자량을 이용해 분자식을 구해보자. 실험식은 물질을 구성하는 성분 원소와 그 원자 수의 비를 나타내는 화학식이다. 과산화수소 H2O2의 실험식은 HO이다. 실험식 HO는 과산화수소를 구성하는 성분 원소로써 수소와 산소이며, 수소 원자 수와 산소 원자 수의 비는 1:1이라는 것을 나타낸다.
실험식을 구하려면 원자 수의 비를 알아야 된다. 그러나 원자와 같이 매우 작은 입자들의 개수의 비를 알아낸다는 것은 쉬운 일이 아니다. 예를 들어 콩 1가마와 깨 1가마가 섞여 있는 상태에서 콩알과 깨알의 개수의 비를 구한다고 가정하면, 콩알과 깨알을 직접 셀 수 없을 것이다. 우선 콩알과 깨알을 체로 분리시키고 콩과 깨의 전체 질량을 각각 측정한 후, 콩의 전체 질량을 콩 1개의 질량으로 나누어주고, 깨 전체 질량을 깨 1개의 질량으로 나누어주면 콩알과 깨알의 수를 구할 수 있다.
마찬가지로 화합물을 구성하는 성분 원자의 개수의 비도 직접 셀 수 없으므로, 성분원소의 질량 비와 원자량을 이용해 구한다. 예를 들면 어떤 탄화수소의 성분 원소인 탄소와 수소의 질량비가 6:1일 때, 탄소의 원자량(12)과 수소의 원자량(1)으로 각각을 나누면 원자 수의 비가 얻어지며 이를 이용해 실험식을 구한다.
분자식은 분자를 구성하는 원소의 종류와 원자 수를 나타낸 화학식이다. 분자식을 구성하는 원자 수는 실험식을 구성하는 원자 수의 정수(n) 배가된다. 이때 정수(n)는 분자량을 실험식량으로 나누어준 값이 된다.
이와 같이 분자식은 실험식과 분자량을 이용해 구한다. 예를 들어 어떤 기체의 실험식이 CH2이고, 분자량은 28이다. 그러면 분자식은 아래와 같이 얻을 수 있다.
수소 기체와 산소 기체를 반응시키면 물이 된다. 이때 수소 기체와 산소 기체는 1:8의 질량 비로 반응한다. 예를 들면 수소 10g을 공기 중에 연소시키면, 산소 80g과 반응해 물 90g이 생성된다. 공기 중에 산소가 아무리 많이 있어도 80g만이 수소 10g과 반응할 수 있다. 반면에 물을 분해하면 수소와 산소의 질량 비는 1 : 8이 된다. 즉 물 90g을 전기 분해하면 수소 10g과 산소 80g이 생성된다.
이와 같이 어떤 물질을 구성하는 성분 원소들 사이에는 일정한 질량의 비가 성립한다. 이것을 ‘일정 성분비의 법칙’이라 한다. <표 1>은 몇 가지 물질의 성분 원소에 대한 질량의 비를 나타낸다.
자연계에는 성분 원소의 종류와 성분비가 똑같은 화합물은 존재하지 않는다. 바꿔 말해, 어떤 화합물들의 성분 원소의 종류와 성분비가 같다면 그 화합물은 똑같은 물질인 것이다. 암모니아(NH3)의 성분 원소인 질소와 수소의 질량비는 14:3이다. 어떤 화합물의 성분을 분석했을 때 질소와 수소가 14:3이면 그 화합물은 암모니아다. 마찬가지로 황과 산소가 1:1로 화합한 물질은 이산화황일 것이다.
화학물의 성분비와 이론 공연비
그렇다면 화합물의 성분비는 어떻게 구할까?
화합물의 성분비는 화학식과 원자량(주기율표에 있음)으로 알 수 있다. 물은 화학식이 H2O이고, H와 O의 원자량은 각각 1과 16이다. H2O는 수소 원자 2개와 산소 원자 1개가 결합해 물분자를 이루고 있다는 뜻이다. 수소와 산소의 성분비는 원자 수와 원자량을 곱한 값의 비이다.
즉